Wir sind am 01.04. umgezogen! Unsere neue Adresse ist: Reimerstwiete 11, 20457 Hamburg
Bibliographische Zulassungsanträge gewinnen in der Pharmaindustrie immer mehr an Popularität, doch mit dem zukünftigen EU-Pharmapaket könnte dies bald ein Ende haben.
Die Möglichkeiten, einen Zulassungsantrag für Arzneimittel gemäß EU/2001/83 zu stellen, sind vielfältig. Neben dem umfassenden Vollantrag (nach Art. 8.3), dem generischen Antrag (nach Art. 10.1) und dem Hybrid-Antrag (nach Art 10.3) gibt es noch eine Sonderform des Zulassungsantrags, den bibliographischen Antrag (nach Art. 10a), der auch als well-established use (WEU) Antrag bezeichnet wird. Bei diesem entfällt die Notwendigkeit, eigene präklinische und klinische Daten in den Modulen 4 und 5 vorzulegen. Voraussetzung dafür ist der Nachweis, dass die Wirkstoffe des betreffenden Arzneimittels bereits seit mindestens einem Jahrzehnt innerhalb der europäischen Gemeinschaft allgemein medizinisch verwendet wurden und zugleich eine anerkannte Wirksamkeit sowie eine annehmbare Unbedenklichkeit aufweisen.
Der bibliographische Zulassungsantrag hat je nach Blickwinkel verschiedene Vor- und Nachteile. Aus Sicht der Behörden und der Patientensicherheit gilt ein Vollantrag mit klinischen und präklinischen Studien als Goldstandard. Der bibliographische Zulassungsantrag hingegen ist eine Konzession an die Notwendigkeit für spezielle medizinische Produkte und historische Behandlungsoptionen. Im Hinblick auf die Versorgungssicherheit spielt dieses schnelle und kostengünstige Verfahren eine entscheidende Rolle. Da der Antragsteller positive und negative Literaturdaten einbeziehen und fehlende Informationen kontrovers diskutieren muss, um die Wirksamkeit und Sicherheit des Arzneimittels nachzuweisen, wird aber auch bei diesem Zulassungsantrag eine adäquate Patientensicherheit gewährleistet.
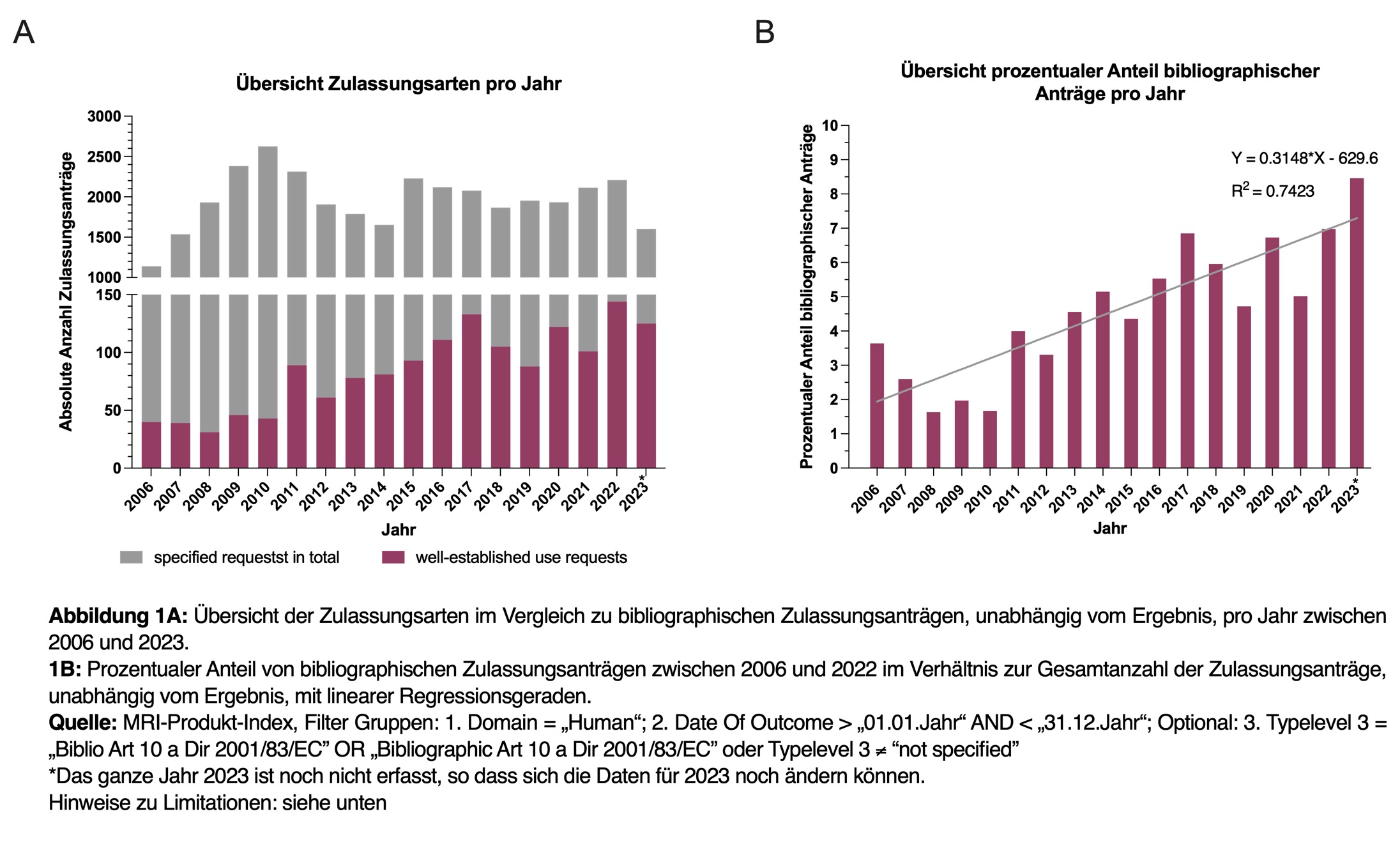
Eine Analyse der im europäischen MRI-Produkt-Index gelisteten Arzneimittel, dessen Zulassungen in Verfahren der gegenseitigen Anerkennung (RMP) oder im dezentralisierten Verfahren (DCP) beantragt wurden, zeigt, dass sich bibliographische Zulassungsanträge immer größerer Beliebtheit bei den Antragstellern erfreuen (siehe Abbildung 1A).
Zwischen den Jahren 2006 und 2023 schwankte die absolute Anzahl an Zulassungsanträgen zwischen 1.100 Anträgen als Tiefpunkt im Jahr 2006 und 2.600 Anträgen als Hochpunkt im Jahr 2010. Die absolute Anzahl an bibliographischen Zulassungsanträgen bewegte sich zwischen 30 Anträgen (im Jahr 2008) und 140 Anträgen (im Jahr 2022) mit steigender Tendenz.
Die durchschnittliche Anzahl der bibliographischen Anträge im Verhältnis zur Gesamtzahl der Zulassungsanträge stieg innerhalb des Zeitraums von 2006 bis 2023 um ca. 5,4 % an und zeigt dadurch einen deutlichen Aufwärtstrend (siehe Abbildung 1B).
Über die Gründe des steigenden Trends von bibliographischen Zulassungsanträgen lässt sich allerdings nur spekulieren. Die Industrie zeigt vermutlich verstärktes Interesse an bibliographischen Zulassungsanträgen, da diese eine schnellere und kostengünstigere Option darstellen, ohne den Aufwand von klinischen und präklinischen Studien.
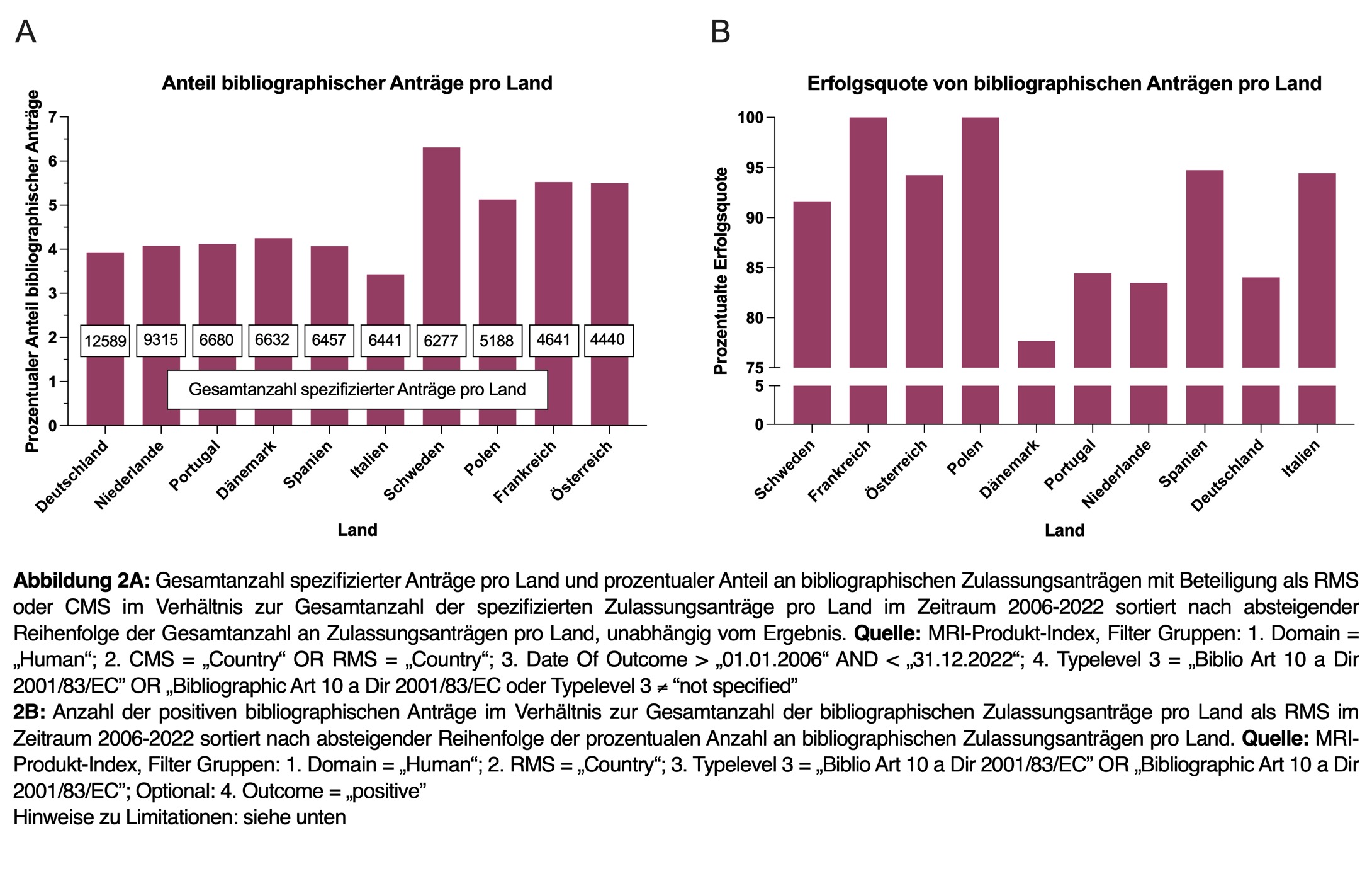
Wie in Abbildung 2A dargestellt, werden die einzelnen europäischen Länder unterschiedlich oft an bibliographischen Zulassungsverfahren als RMS oder CMS beteiligt. So wurden in Deutschland im Zeitraum von 2006 bis 2022 mit mehr als 12.500 Zulassungsanträgen die meisten Anträge gestellt. Dahinter liegen die Niederlande, mit mehr als 9.000 Zulassungsanträgen, gefolgt von Portugal, Dänemark, Spanien, Italien und Schweden mit jeweils mehr als 6.000 Zulassungsanträgen und Polen, Frankreich und Österreich mit ca. 4.000 bis 5.000 Zulassungsanträgen.
In diesen Ländern, in denen viele Zulassungsanträge gestellt werden, scheinen Bedingungen zu herrschen, die einen Anreiz für Antragsteller, möglicherweise durch lukrative Märkte oder leichte Zulassungsverfahren, darstellen.
Bei der Betrachtung von bibliographischen Zulassungsanträgen in den verschiedenen europäischen Ländern (RMS oder CMS) mit mehr als 4.000 Zulassungsanträgen zwischen 2006 und 2022 fällt auf, dass die Anzahl der bibliographischen Anträge im Vergleich zur Gesamtanzahl der Zulassungsanträge in den verschiedeneren Ländern stark schwankt (siehe Abbildung 2A). So kann unter den betrachteten Ländern Schweden mit ca. 6 % den höchsten prozentualen Anteil an bibliographischen Zulassungsanträgen verzeichnen, wohingegen Italien mit ca. 3,5 % an bibliographischen Zulassungsanträgen am unteren Ende der Skala liegt. In Deutschland sticht der prozentuale Anteil an bibliographischen Zulassungsanträgen mit knapp 4 % nicht heraus und liegt ebenfalls am unteren Ende der Skala. Eine mögliche Ursache für den geringen prozentualen Anteil an bibliographischen Anträgen könnte z. B. die strenge Beurteilung durch die deutsche Behörde darstellen.
Denn bei der Wahl des RMS für bibliographische Zulassungsanträge berücksichtigen Unternehmen insbesondere ihre Chance auf eine erfolgreiche Zulassung. Betrachtet man den prozentualen Anteil erfolgreicher Zulassungen in den EU-Ländern mit mehr als 4.000 Zulassungsanträgen im Zeitraum zwischen 2006 und 2022, werden eindeutige Unterschiede bei der Erfolgsquote erkennbar (siehe Abbildung 2B). Nur Frankreich und Polen weisen eine 100 %ige Erfolgsquote bei bibliographischenZulassungsanträgen auf. In Dänemark war die Erfolgsquote mit unter 80 % dagegen am geringsten. Mit knapp 85 %iger Erfolgsquote befindet sich Deutschland im unteren Mittelfeld.
Für ein geplantes bibliographisches Zulassungsverfahren eignen sich den bloßen Zahlen nach vermutlich Frankreich und Polen als RMS, da sie durch mehr als 250 bibliographische Zulassungsanträge seit 2006 schon viel Erfahrungen mit dem Verfahren haben und eine 100 %ige Erfolgsquote aufweisen. Trotzdem ist die Wahl des RMS natürlich immer individuell zu beurteilen und die polnische oder französische Behörde keinesfalls als allgemein gültige Empfehlung zu betrachten.
Bei der Interpretation der Ergebnisse ist es wichtig zu beachten, dass eine 100 %ige Erfolgsquote nicht zwangsläufig darauf hinweist, dass das Land als RMS keinerlei Herausforderungen birgt. Möglicherweise spielen bei der Erfolgsquote von bibliographischen Zulassungsanträgen effiziente Prüfungsverfahren, transparente Kommunikation mit dem Antragsteller, aber auch Expertise und evtl. auch die Kapazität der Behörde oder die Ortsansässigkeit der Antragsteller eine entscheidende Rolle.
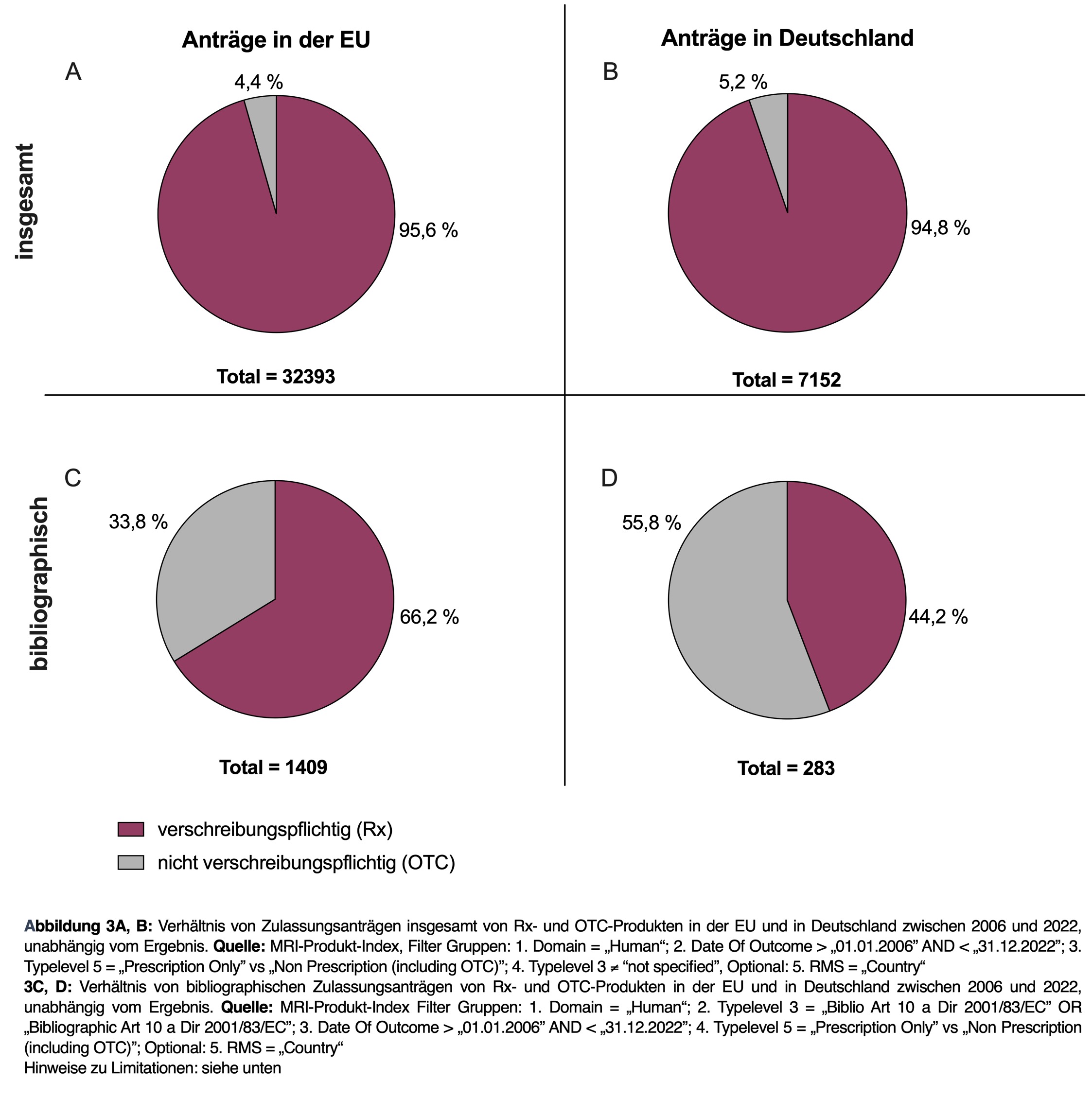
Der Vergleich aller Zulassungsanträge bei verschreibungspflichtigen (Rx) und nicht verschreibungspflichtigen (OTC) Arzneimitteln zwischen 2006 und 2022 in der EU zeigt, dass von den über 32.000 Anträgen nur 4,4 % der Anträge für OTC-Produkte gestellt wurden (siehe Abbildung 3A). Im Vergleich mit den insgesamt in Deutschland gestellten Zulassungsanträgen zeigt sich mit 5,2 % der Anträge für OTC-Produkte ein ähnliches Verhältnis (siehe Abbildung 3B).
Bei der Betrachtung der bibliographischen Zulassungsanträge bei verschreibungspflichtigen und nicht verschreibungspflichtigen Arzneimitteln zwischen 2006 und 2022 in der EU wird deutlich, dass mit 66,2 % der Anträge doppelt so viele bibliographische Zulassungsanträge für verschreibungspflichtige Arzneimittel gestellt wurden, wie für nicht verschreibungspflichtige Arzneimittel (siehe Abbildung 3C).
Fungiert Deutschland bei dem bibliographischen Zulassungsantrag als RMS, zeigt sich ein anderes Bild (siehe Abbildung 3D). Mit Deutschland als RMS werden deutlich mehr bibliographische Zulassungsanträge für OTC-Produkte gestellt (55,8 %) als im Vergleich zum Durchschnitt aller RMS in der EU (33,8 %).
In Deutschland gibt es einen großen Markt für alternative Medizin, in dem der Fokus nicht auf Rx-Produkten liegt. Unternehmen haben großes Interesse daran, vor allem OTC-Produkte in Deutschland auf den Markt zu bringen. Dafür scheint sich ein bibliographischer Zulassungsantrag besser anzubieten als andere Antragsarten. Vermutlich ist die verfügbare Literatur für OTC-Produkte sehr umfassend, so dass sich bei diesen Produkten, die für einen bibliographischen Zulassungsantrag geforderte allgemeine medizinische Verwendung einfach nachweisen lässt. Möglicherweise fällt es auch den Behörden leichter, das Sicherheitsprofil von OTC-Produkten positiv zu bewerten.
Die Bezeichnung „bibliographischer Zulassungsantrag“ mag zwar zunächst mit verstaubten Büchern assoziiert werden, erfreut sich aber trotzdem großer Beliebtheit, denn es werden immer mehr Arzneimittel über diese Verfahrensart zugelassen. Der steigende Zuspruch und Erfolg von bibliographischen Zulassungsanträgen legen nahe, dass sie nicht nur als Ergänzung, sondern als eine wertvolle Alternative zu herkömmlichen Zulassungsverfahren betrachtet werden sollten, die möglicherweise den Weg für eine schnellere Verfügbarkeit sicherer und wirksamer Therapien in der Medizin ebnen.
Diesen Aufwärtstrend von bibliographischen Zulassungsverfahren bekommen wir in unserer täglichen Arbeit auch zu spüren. Als beratender Dienstleister der Pharmabranche erreichen uns immer mehr Anfragen für bibliographische Zulassungsverfahren.
Behörden stehen bibliographischen Zulassungsanträgen jedoch leider skeptisch gegenüber. In den minutes for the meeting vom 18.-20. Juli 2023 der Coordination Group for Mutual Recognition and Decentralised Procedures- Human (CMDh) heißt es übersetzt, dass Antragstellern dringend von einem bibliographischen Antrag abgeraten wird, sofern ein Referenzarzneimittel auf dem Markt verfügbar ist. In solchen Fällen sollen generische Anträge eingereicht werden.
Auch im EU-Pharmapaket soll eine Änderung integriert werden, in der es heißt, dass künftig nur ein bibliographischer Antrag gestellt werden soll, wenn innerhalb der EU kein Referenzarzneimittel für den gleichen Wirkstoff für dieselbe therapeutische Anwendung und für den gleichen Verabreichungsweg zugelassen ist oder war. Ansonsten ist ein generischer oder Hybridantrag zu stellen. Daher würde selbst eine nicht mehr bestehende Zulassung in einem EU-Land, einen bibliographischen Antrag verhindern. Allerdings zeichnet sich jetzt schon ab, dass die Verhandlungen langwierig und zäh werden – nicht zuletzt, weil das Gesetzesvorhaben so umfangreich ist. Auch wird im Frühjahr 2024 das EU-Parlament neu gewählt. Insofern ist nicht davon auszugehen, dass das Gesetz in den kommenden 2 Jahren in Kraft tritt. Eine gute Nachricht für derzeit geplante bibliographische Zulassungsverfahren mit einem in der EU zugelassenen Referenzarzneimittel.
Diese (neuen) sehr strengen Regelungen würden dieses effiziente, schnelle und kosteneffektive Verfahren der bibliographischen Zulassung enorm erschweren. Passé wären sie dann (noch) nicht, aber die Kriterien dafür würden deutlich verschärft werden, was den Aufwärtstrend der bibliographischen Zulassung bremsen könnte.
Für den Erfolg eines bibliographischen Zulassungsantrags ist es sehr empfehlenswert, die Anforderungen, Möglichkeiten, Hürden, Strategien und Erfolgschancen genauestens zu durchdenken. Grundsätzlich empfehlen wir, das Vorgehen sowie die Inhalte der Dokumentation mit den zuständigen Behörden im Rahmen eines Scientific Advice im Vorfeld abzustimmen.
Hinweise zu Limitationen: